产品分类
公司荣誉
公司图片
联系方式
公司新闻
云序用户文章|IF=19.865,多组学分析助力非酒精性脂肪性肝病发病机制研究
发布时间:2022-11-04 14:11 | 点击次数:
非酒精性脂肪性肝病(NAFLD)是由肝脏脂质代谢失衡引起的,但发病机制尚未完成阐明。2022年9月1日,云序客户的研究者们在Nature Metabolism(IF=19.865)杂志上发表了文章“Orosomucoid 2 maintains hepatic lipid homeostasis through suppression of de novo lipogenesis”。该研究通过多种小鼠模型,首次揭示了肝脏分泌因子Orosomucoid 2 (ORM2)通过特异性抑制脂质从头合成途径(DNL),维持肝脏和全身脂质稳态的作用。此项研究结果表明,肝脏ORM2信号通路是脂质代谢重要调节因子,为NAFLD、NASH和高脂血症提供了一个潜在的干预靶点。云序生物有幸参与了此项研究中的RNA-seq、磷酸化蛋白质谱、CoIP-质谱法等高通量技术服务。
影响因子:19.865
发表时间:2022年9月1日
研究方法:RNA-seq、磷酸化蛋白质谱、CoIP-质谱法
文章链接:Orosomucoid 2 maintains hepatic lipid homeostasis through suppression of de novo lipogenesis
云序提供的服务



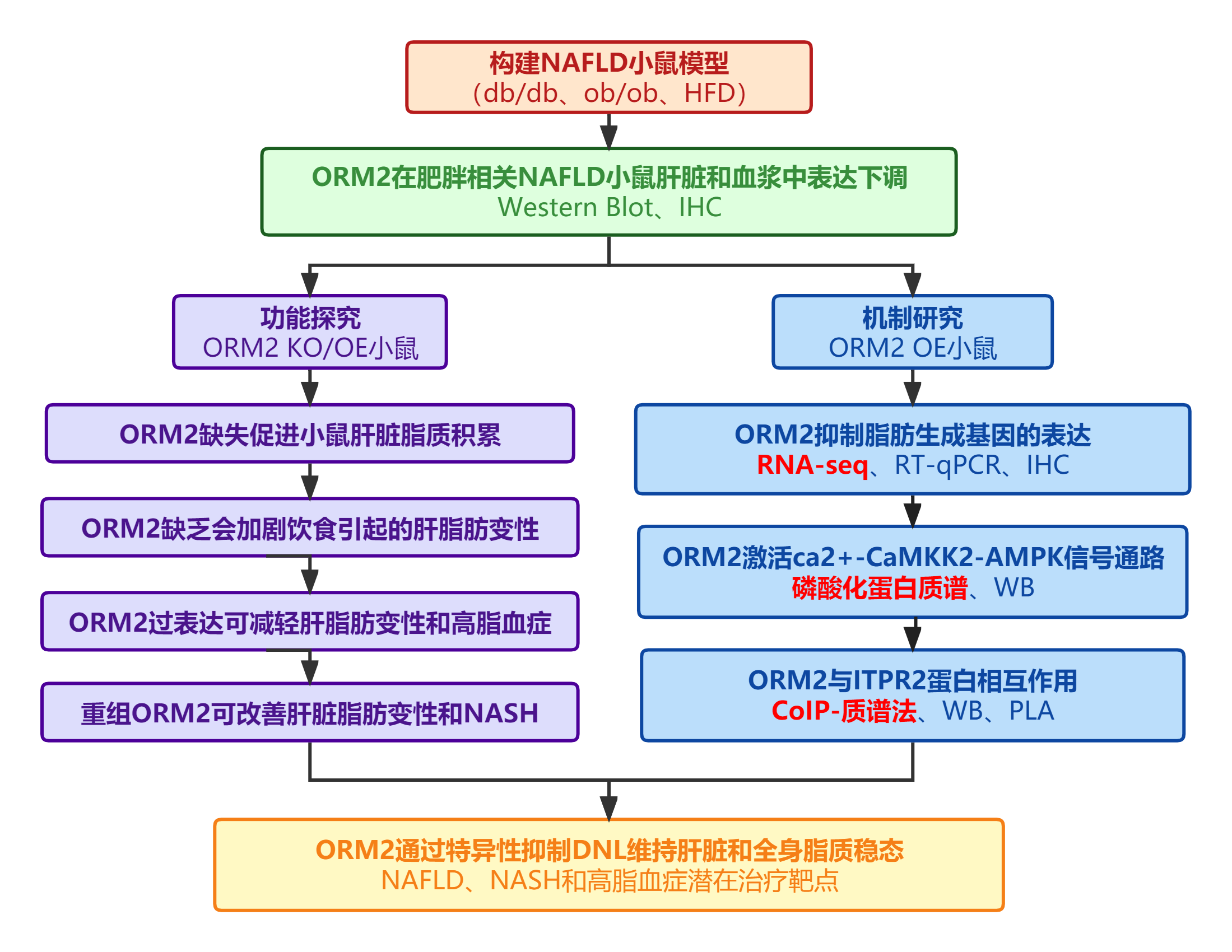
技术路线
研究内容
1. ORM2在NAFLD小鼠中下调为了探究ORM2是否参与肝脏脂质调节,作者使用了三种类型的NAFLD小鼠模型(瘦素受体缺陷的db/db、瘦素缺陷的ob/ob、高脂饮食喂养的HFD)检测了其在肝脏和血浆中的表达。结果显示,与对照组相比,NAFLD小鼠的肝脏和血浆中ORM2蛋白水平均显著降低(图1a-f)。
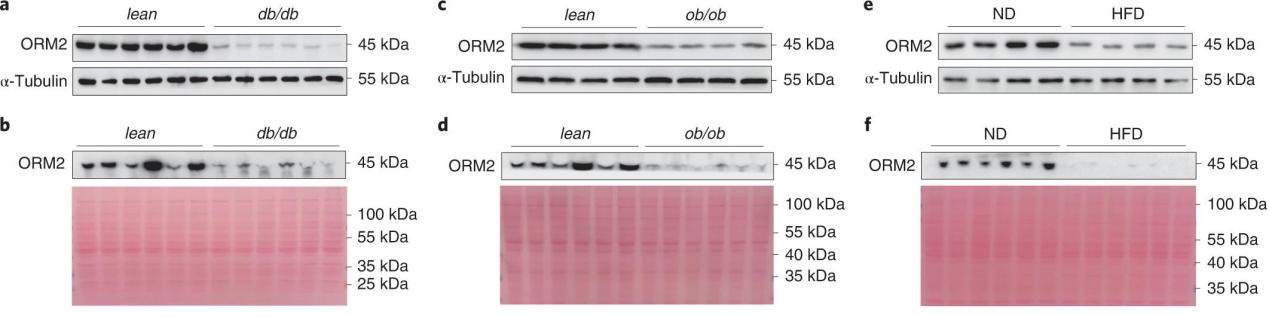
图1. ORM2在NAFLD小鼠肝脏和血浆中下调
2. ORM2缺失促进小鼠肝脏脂质积累
ORM2在NAFLD中表达下调提示其可能参与了肝脏TG代谢的调控。因此,作者构建了ORM2基因野生型(WT)、杂合子(HE)和敲除(KO)小鼠(图2a-b)用于后续研究。与WT小鼠相比,KO小鼠肝脏中ORM2的mRNA表达水平极低,而ORM1和ORM3的mRNA水平均不受ORM2缺失的显著影响,证实了KO小鼠肝脏中ORM2的缺失,且没有ORM1和ORM3的代偿性上调(图2c)。值得注意的是,在正常饲料(ND)喂养下,与WT小鼠相比,KO小鼠的肝脏与体重比、肝脏和血浆TG水平显著升高(图2d-g)。同时,与野生型雌性小鼠相比,ORM2缺陷的雌性小鼠的肝脏和血浆TG水平升高(图2h-l)。因此,ORM2可能在肝脏TG稳态的生理维持中发挥不可或缺的作用,且ORM2在肝脏和全身TG稳态中的保护作用可能与性别无关。
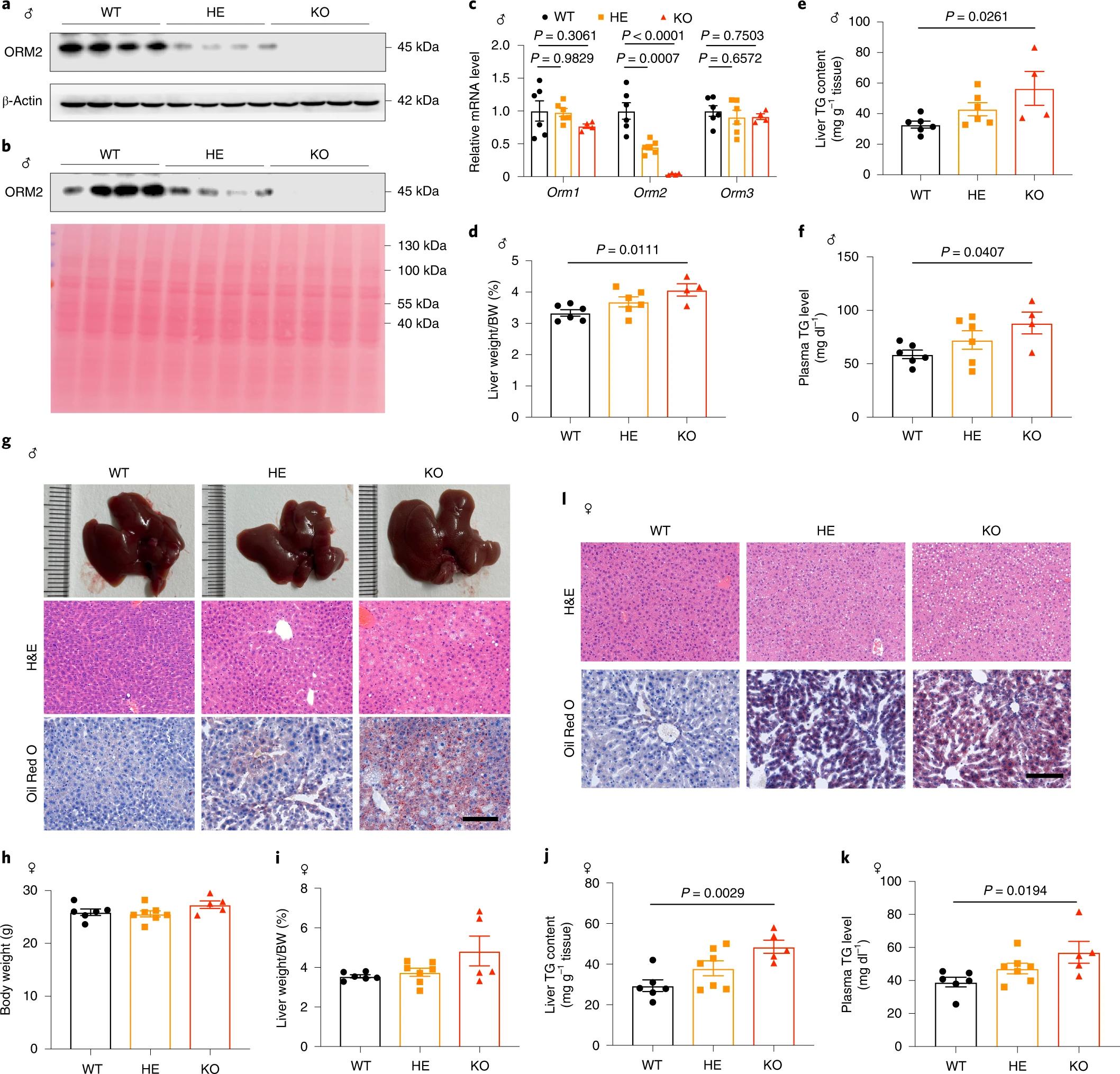
图2. ORM2 KO雄性和雌性小鼠在ND条件下均表现出肝脏TG的积累
3. ORM2缺乏会加剧饮食引起的肝脂肪变性
作者用HFD喂养小鼠8周,以诱导单纯性脂肪变性后,发现与野生型小鼠相比,KO小鼠发生了更严重的肝脂肪变性,肝体重比更高,肝脏和血浆TG水平升高(图3a-c),脂质积累加重(图3b-d)。接下来,作者用HFHC饮食喂养小鼠24周,以诱导NASH发病机制。与WT小鼠相比,HE和KO雄性小鼠的肝重比更大,肝脏和血浆TG含量更高(图3e-g)。ORM2缺陷小鼠的血浆ALT和AST水平显著升高(图3h-i),同时表现出F4/80阳性巨噬细胞丰度增加和更严重的肝纤维化(图3j-l)。在HE和KO小鼠的肝脏中,参与肝脏炎症和纤维化的基因的表达水平一致上调(图3m)。以上数据表明,ORM2缺乏加剧了饮食诱导的脂肪变性和脂肪性肝炎。
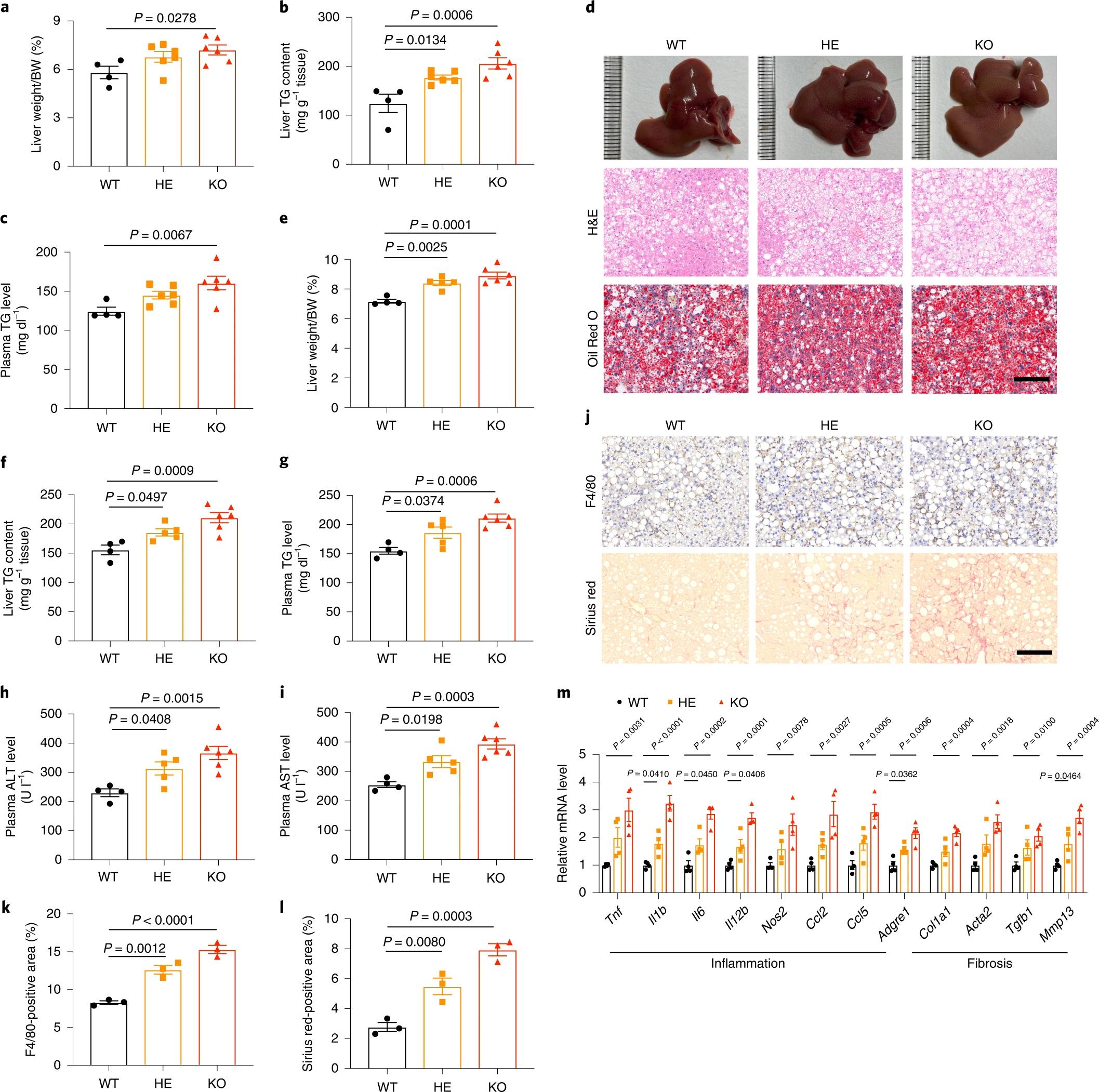
图3. ORM2缺乏加剧了饮食诱导的肝脏脂质沉积和脂肪性肝炎
4. ORM2过表达可减轻肝脂肪变性和高脂血症
为了探究肝脏特异性过表达ORM2是否可以降低肝脏TG水平,改善脂肪变性,作者通过尾静脉注射腺病毒(Ad),以构建肝脏ORM2过表达ob/ob小鼠(图4a-c),以及Ad-GFP阴性对照小鼠。结果表明,Ad-ORM2处理对体重和食物摄入量没有影响(图4d-e),但Ad-ORM2小鼠的肝脏体重比、肝脏和血浆TG含量显著低于表达Ad-GFP的小鼠(图4f-h)。在ORM2过表达的小鼠中,脂滴较小,含量较少(图4i),血浆总胆固醇(TC)和LDL-C水平较低(图4j-k)。总之,ORM2表达恢复可以改善肥胖相关的肝脂肪变性和血脂异常。为了进一步确定ORM2的保护作用,作者使用肝特异性甲状腺激素驱动的腺相关病毒(AAV)9型AAV-GFP或AAV-ORM2,尾静脉注射C57BL/6J雄性小鼠后,将小鼠ND或HFD喂养12周,分别命名为ND/AAV-GFP、HFD/AAV-GFP和HFD/AAV-ORM2。与ND/AAV-GFP小鼠相比,HFD/AAV-GFP和HFD/AAV-ORM2小鼠的体重逐渐增加,但后两组间小鼠的体重没有明显区别(图4l)。WB结果显示,与ND/AAV-GFP小鼠相比,HFD/AAV-GFP小鼠肝脏中ORM2蛋白水平降低(图4n),但在HFD/AAV-ORM2小鼠肝脏中表达恢复(图4n)。与ND/AAV-GFP小鼠相比,HFD/AAV-GFP小鼠的肝/体重比、肝和血浆TG含量、脂滴积累以及血浆TC和LDL-C水平显著升高(图4o-t)。值得注意的是,AAV-ORM2治疗显著缓解了HFD相关的脂质代谢恶化(图4o-t)。因此,这些发现表明AAV介导的ORM2表达可以防止HFD诱导的肝脂肪变性和血脂异常的发生。
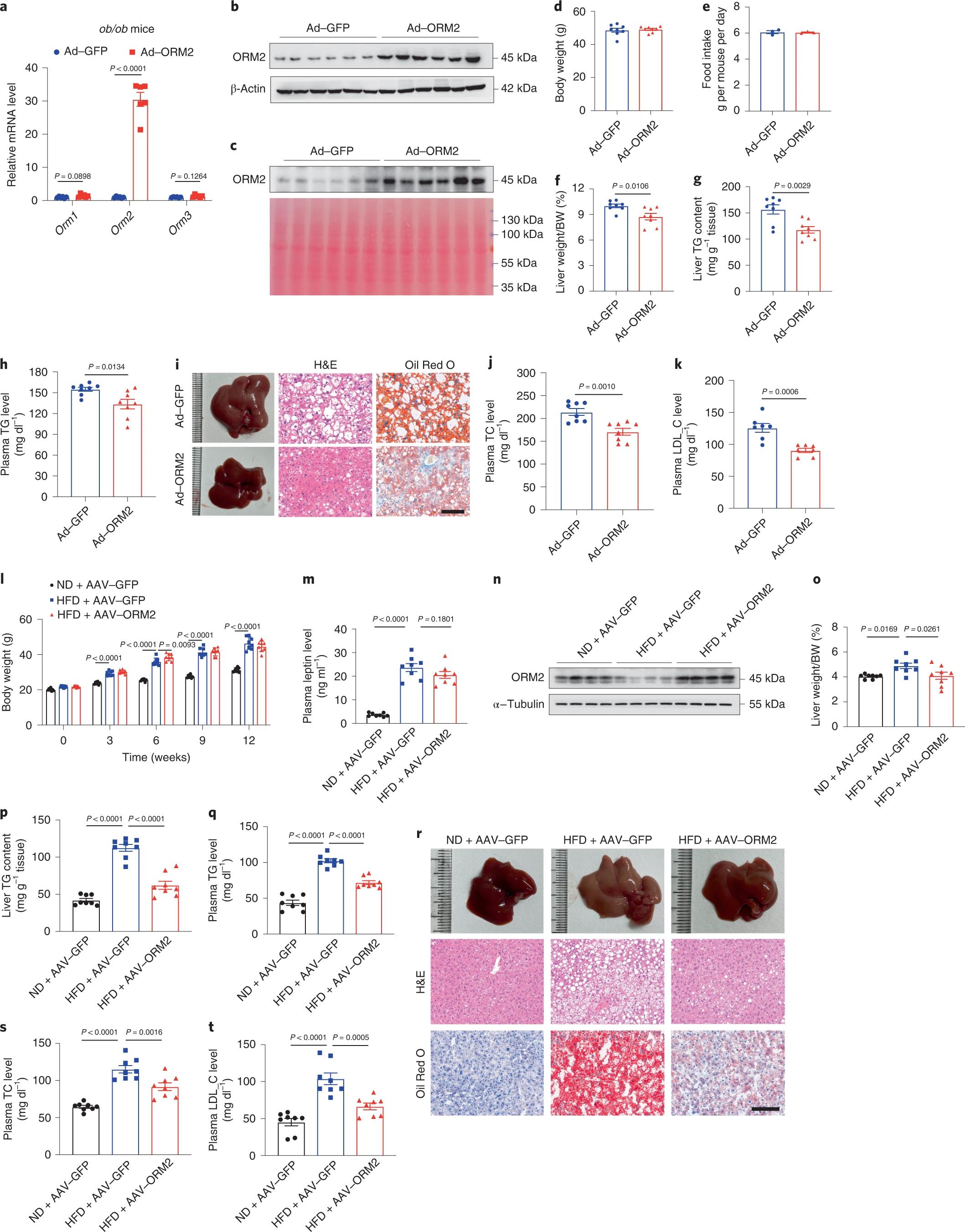
图4. ORM2过表达可减轻肥胖小鼠的肝脂肪变性和高脂血症
5. ORM2抑制脂肪生成基因的表达
为了探究ORM2维持肝脏脂质稳态的下游靶点,作者对Ad-ORM2和Ad-GFP转导的ob/ob小鼠的肝脏进行了RNA-seq测序分析,结果显示Ad-ORM2处理抑制了大多数基因(图5a)。以P值<0.05和fold change >2.0为差异阈值,作者发现表达Ad-ORM2的ob/ob小鼠肝脏中有90个基因(28.75%)表达上调,223个基因表达下调(71.25%)(图5b)。GO分析表明,下调的基因在脂肪酸代谢过程中高度富集(图5c)。RT-qPCR证实,表达Ad-ORM2的ob/ob小鼠中SREBP-1c及其下游基因(Fasn、Scd1和Acc1)的mRNA表达水平显著降低(图5d)。通过对肝提取物进行免疫印迹证实,在蛋白水平上也出现了脂肪生成基因的下调(图5e)。Ad-ORM2转导也导致db/db小鼠(图5f、g)和HFD小鼠(图5h、i)肝脏中脂肪生成基因的表达显著降低。此外,与HFD/AAV-GFP小鼠相比,HFD/AAV-ORM2小鼠的脂肪生成基因表达减少,达到了与ND/AAV-GFP小鼠相似的水平(图5j,k)。与WT小鼠相比,在ND或HFD喂养条件下,ORM2 HE和KO小鼠的肝脏中均脂肪生成基因表达上调(图5l-o)。这些发现表明,ORM2可能通过下调与DNL相关的基因表达来维持肝脂质稳态。
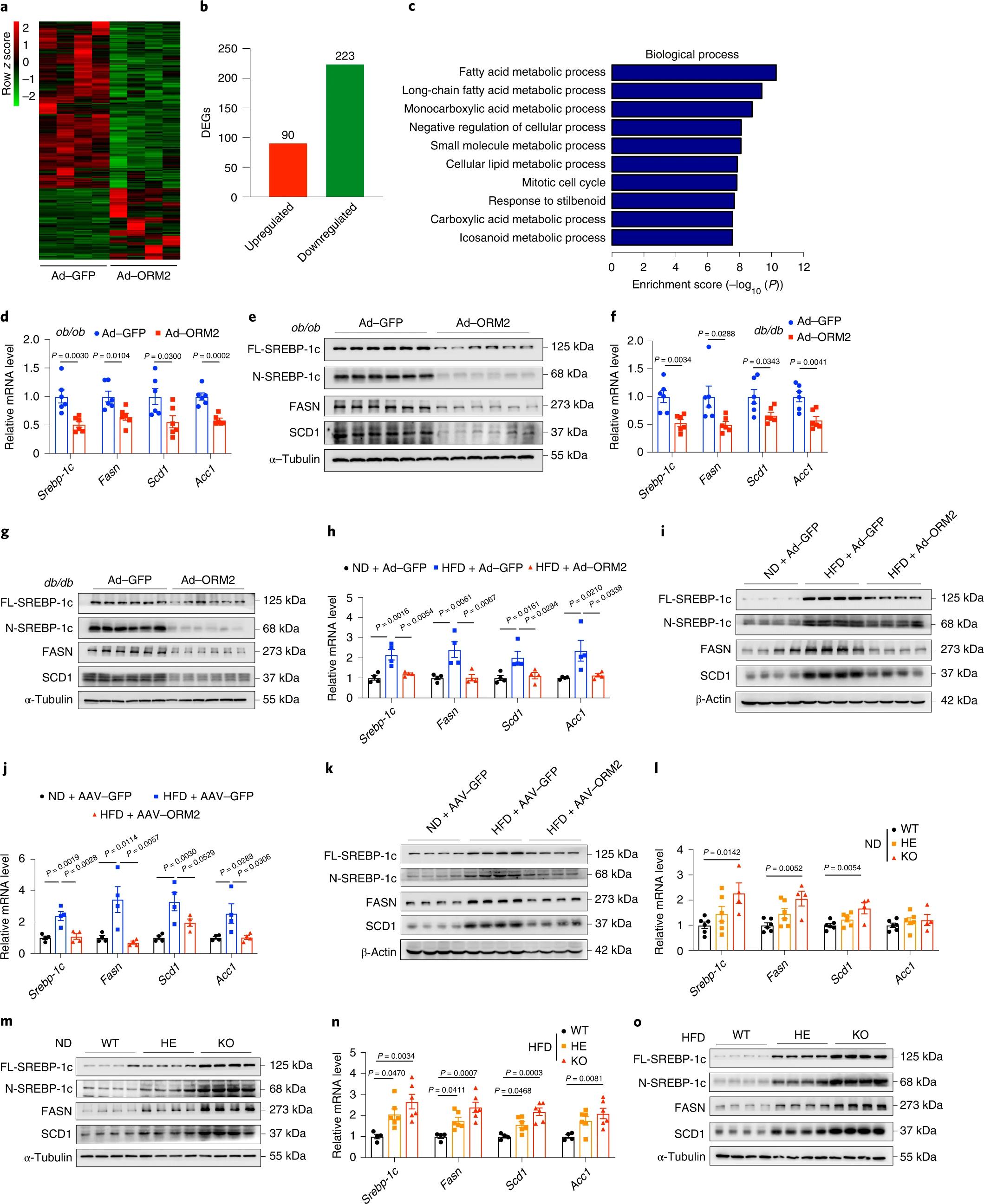
图5. ORM2下调脂肪生成基因
6. ORM2激活ca2+-CaMKK2-AMPK信号通路抑制DNL
为了探究对ORM2应答的细胞内信号通路,作者使用来自Ad-ORM2或Ad-GFP转导的ob/ob小鼠的肝脏进行了磷酸化蛋白质谱分析。基于差异磷酸化肽及其KEGG通路的富集,作者发现AMPK信号通路被高度激活(图6a-b)。WB证实,与表达Ad-GFP的ob/ob小鼠相比,表达Ad-orm2的ob/ob小鼠肝脏中AMPK及其靶点ACC的磷酸化水平显著增强(图6c)。在ORM2过表达的小鼠中,mTOR信号,包括mTOR和P70S6K的磷酸化被抑制(图6c);而AKT和STAT3的磷酸化状态在Ad-ORM2处理后没有改变(图6c)。同样,在过表达ORM2的db/db小鼠的肝脏中,可以观察到AMPK信号通路的激活和mTOR信号通路的抑制(图6d)。接下来,作者进行了体外研究来检测ORM2对肝细胞的直接作用。结果发现,内源性ORM2的敲除显著增加了HPHs中细胞TG的积累,并上调了脂肪生成基因的表达(图6e-g)。相反,ORM2重组蛋白处理显著降低了HPHs中细胞TG含量,下调了脂肪生成基因(图6h-i)。同时,无论是ORM2敲低还是处理,参与脂肪酸氧化和脂质转运的基因的表达水平均不受影响(图6g-i)。此外,肝脏特异性Prkaa1和Prkaa2双敲除(DKO)雄性小鼠(Prkaa DKO)的MPHs显示,ORM2介导的对细胞TG积累和脂肪生成基因表达的抑制显著消失(图6j-l)。因此,AMPK激活是ORM2必要的下游信号效应器。此外,Prkaa WT肝细胞显著降低了DNL率(图6n);然而,Prkaa DKO细胞中这种作用减弱(图6o)。同时,重新引入ORM2显著抑制了ORM2 KO肝细胞中的DNL率(图6p),OTO-609明显消除了ORM2对DNL率的抑制(图6q)。总之,这些发现证明了ORM2在抑制DNL中的直接作用,而DNL依赖于CaMKK2和AMPK。
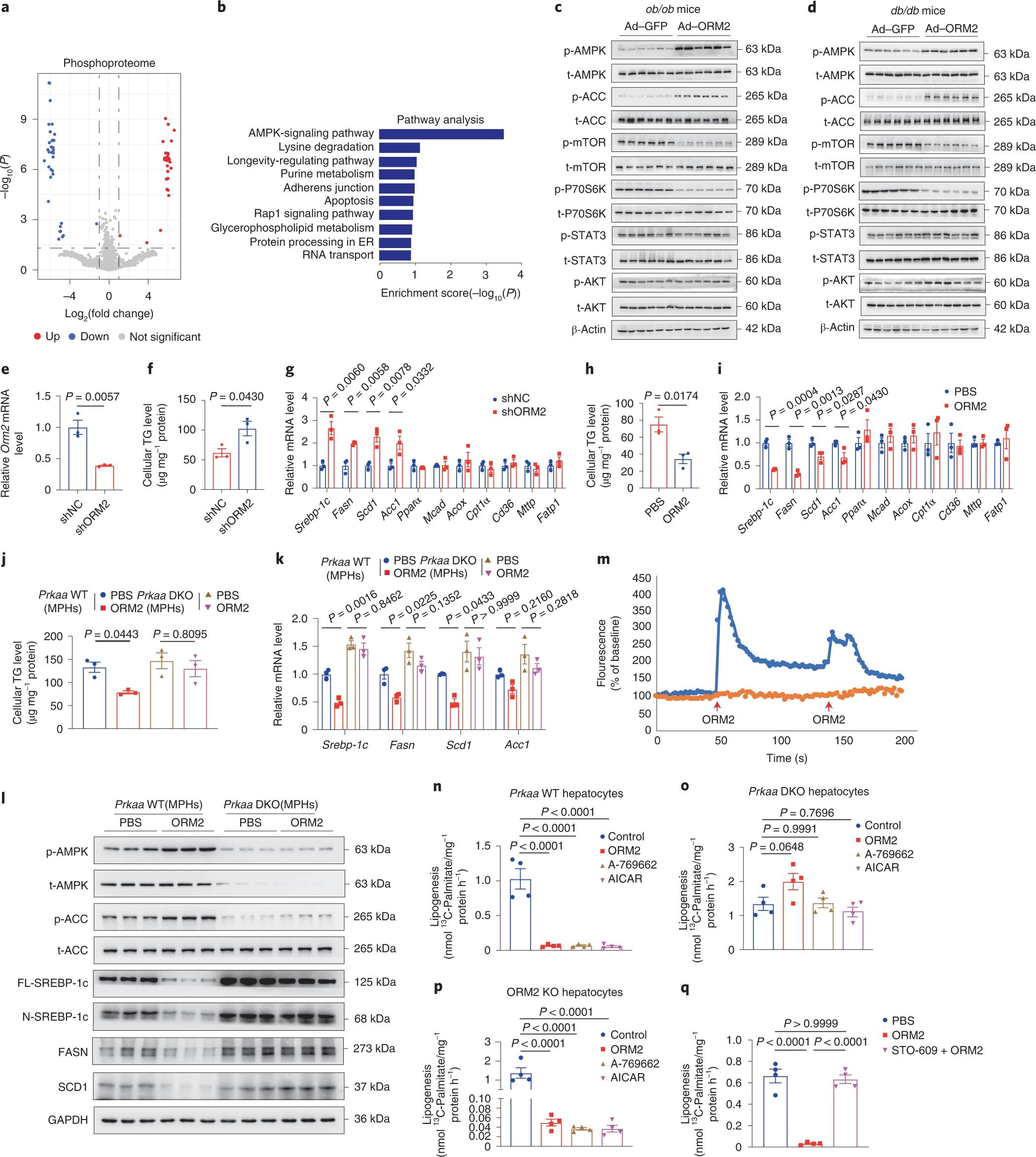
图6. ORM2激活AMPK信号来抑制DNL
7. ORM2与ITPR2相互作用的鉴定
为了鉴定负责ORM2抑制脂肪生成作用的肝脏受体,作者将HA标记的ORM2表达质粒或EV转染到HEK 293T细胞中,HA-ORM2转染显著增强了AMPK的磷酸化(图7a)。然后,作者通过CoIP-质谱法鉴定与ORM2相互作用的蛋白,筛选到了120多种蛋白质。其中,ITPR2和ITPR3已被证实可介导哺乳动物细胞内Ca2+信号网络。因为ITPR3在正常肝脏中缺失,而ITPR2高表达,可定位于肝细胞的质膜(图7b),所以用于后续研究。ORM2和ITPR2之间的物理相互作用也通过免疫共沉淀和接近连接实验(PLA)得到证实(图7c-e)。为了确定ITPR2与ORM2互作位置,作者使用了ITPR2的几种截断形式,分析显示,ITPR2与ORM2相互作用需要结构域(氨基酸226-576)(Fig.7f-g)。然后,为了探究ITPR2的阻断是否会影响ORM2在体内的抗脂作用,作者通过尾静脉注射ob/ob雄性小鼠,给予靶向ITPR2的shRNA或阴性对照,然后用ORM2重组蛋白或载体对照处理。结果发现,注射shRNA ITPR2显著降低了ITPR2在肝脏中的表达(图7h)。虽然四组之间的体重和食物摄入量具有可比性(图7i-j),但ITPR2的下调显著阻断了ORM2对肝脏脂肪变性、高脂血症和脂肪生成基因表达水平的保护作用(图7k-q)。综上所述,ORM2通过涉及Ca2+、CaMKK2和AMPK的ITPR2依赖的信号级联来抑制肝脏脂肪生成。
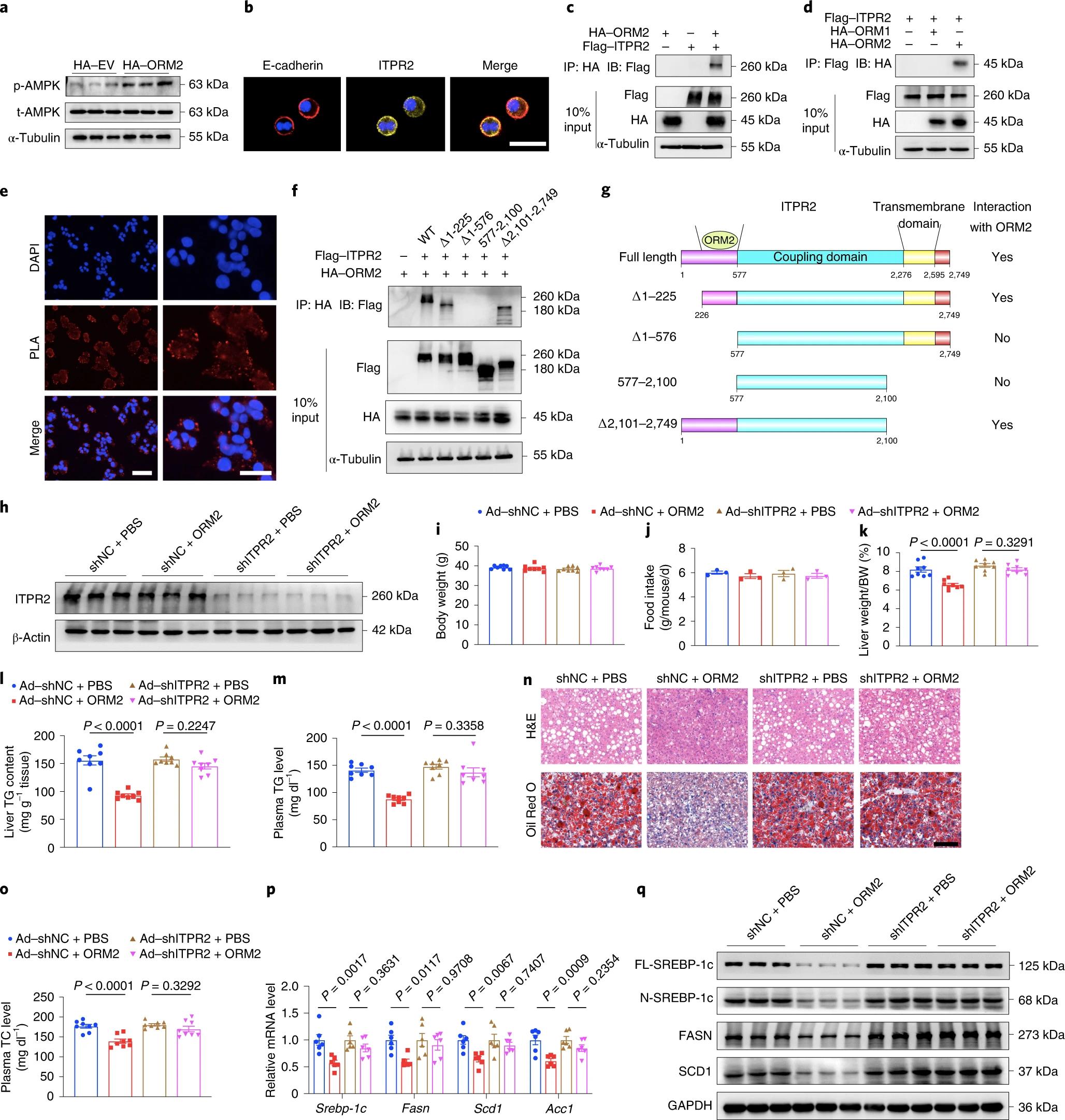
图7. ORM2的肝脏益处需要ITPR2
8. 重组ORM2可改善小鼠肝脏脂肪变性和NASH
ORM2蛋白处理后,ob/ob小鼠肝体重比、肝脏和血浆TG含量、肝脂质积累呈剂量依赖性下降(图8a-d)。与此同时,ob/ob小鼠中脂肪生成基因和促炎基因的表达水平降低,AMPK信号通路被显著激活,而mTOR和P70S6K的磷酸化水平逐渐降低(图8e-g)。ORM2显著逆转了HFHC饲粮诱导的肝体重比和肝TG含量的升高,与此相一致,ORM2处理后降低了血浆ALT和AST水平(图8h-k)。组织学分析显示,饮食诱导的肝脂质积累、炎症和肝纤维化明显减轻(图8l-o)。肝脏的益处伴随着肝脏炎症和纤维化相关基因的表达减少(图8p)。综上所述,重组ORM2蛋白具有治疗NAFLD和NASH的潜力。
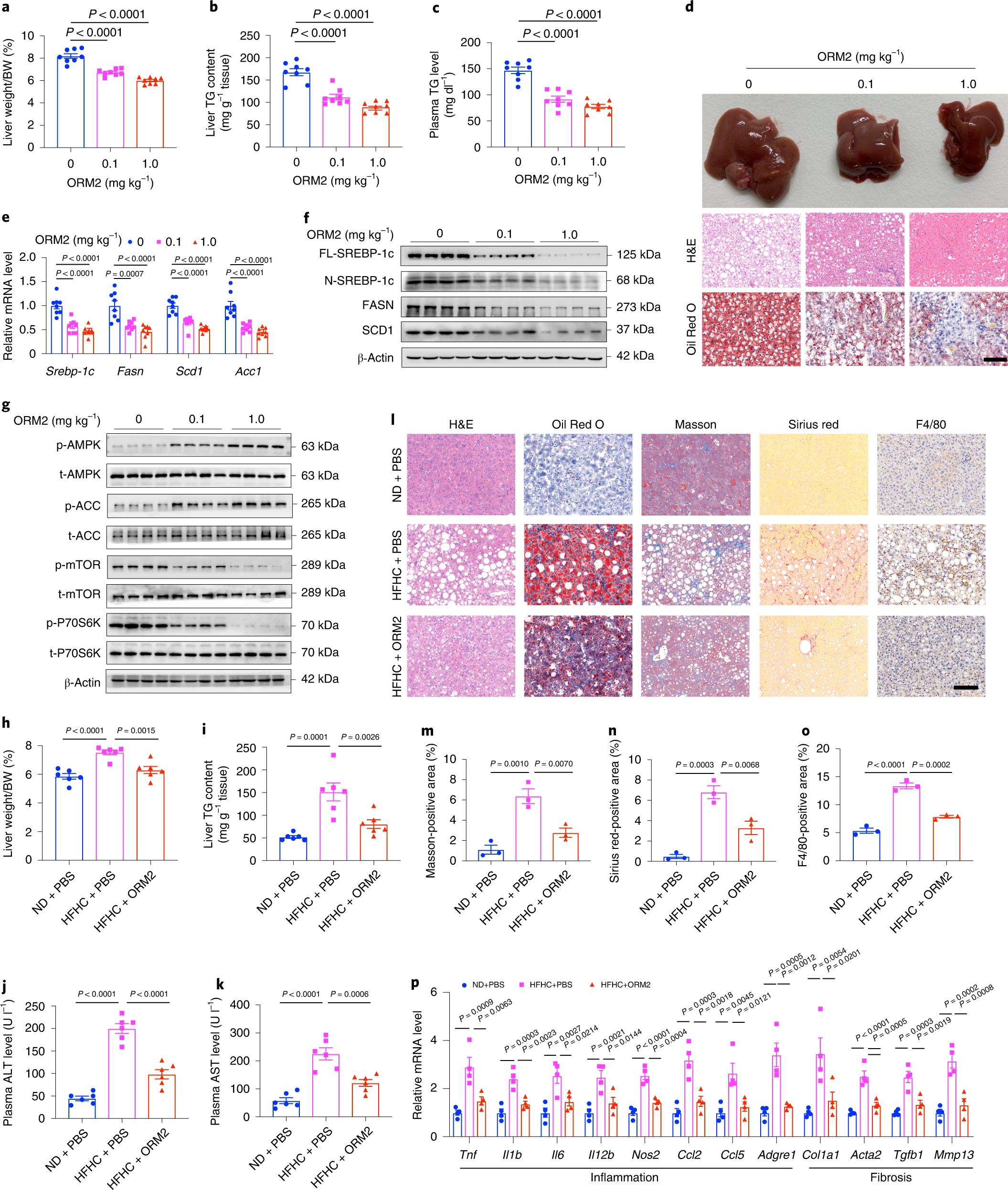
图8. 重组ORM2蛋白可改善饮食诱导的小鼠肝脂肪变性和脂肪性肝炎
小 结
往期回顾
用户文章|1区 IF=17.694:m6A MeRIP-seq 助力饥饿条件下的细胞自噬研究
客户文章1区IF 12+ |m6A甲基化测序助力FTO抑制PTC糖酵解代谢机制研究
客户文章|m6A甲基化测序助力脓毒症诱导的ARDS表位机制研究
1区,IF=27|借力m6A甲基化修饰,探索肾细胞癌耐药性机制研究
1区,IF=27| 云序m6A MeRIP-seq助力鳞状细胞癌机制研究!
超详细图文版:如何实现m6A测序数据可视化?
云序用户 1区,IF=23.168 | 多组学联合分析揭示胰腺癌中 RNA 乙酰化修饰的重要靶点
1区,IF=19.16| 云序RNA乙酰化测序acRIP-seq助力病毒复制机制研究!
客户文章|新型RNA修饰之m7G揭示急性髓系白血病发病机制
1区,IF=16.8| 云序RNA乙酰化测序/acRIP-seq助力心梗机制研究!

上海云序生物科技有限公司
地址: 松江区莘砖公路518号18号2楼
网址: http://www.cloud-seq.com.cn
电话: 021-64878766
邮箱: market@cloud-seq.com.cn
地址: 松江区莘砖公路518号18号2楼
网址: http://www.cloud-seq.com.cn
电话: 021-64878766
邮箱: market@cloud-seq.com.cn




