2018国自然研究热点一:环状RNA研究深度剖析--云序生物
发布时间:2018-11-05 15:45 | 点击次数:
1.环状RNA为什么火?它到底是何方神圣?
2013年两篇Nature[1][2]文章的出世,彻底颠覆了我们对RNA的传统认知,同时也迅速引爆了整个生物医学界!经过严格统计汇总后,2017年国家自然科学金获批的项目中环状RNA研究相关的项目总数高达176项,其中有两项杰出青年基金,一项优秀青年基金,两项重点项目,94项面上项目,62项青年基金项目,15项地区科学基金项目。


从获批学科方向角度分析,发现肿瘤学方向是环状RNA研究获批项目中最多的学科方向,而消化系统相关肿瘤是其中获批最多的学科单项,除此之外,循环系统的环状RNA研究也是异军突起,一跃成为第二大环状RNA研究领域。其实医学方向除了肿瘤学和循环系统以外,其他方向也都获得资助,比如中医学和药理学方向,相信未来其他类型的肿瘤和学科方向必定会争取更多的环状RNA课题资助。与此同时,生命科学方向环状RNA研究显得略微低调些,从获批的16个项目来看,基础的遗传学和生物信息学(C06)和畜牧业(C1701)相对受到更多的重视,相信如果突破相关研究领域的技术瓶颈,在生命科学方向会出现更多的环状RNA研究

从获批研究内容分析,发现与2016年相比,2017年获批的项目中,只进行环状RNA表达谱分析的课题非常少,绝大部分是针对环状RNA的功能机制展开,这表明环状RNA研究已经实现从基础筛选到特定功能机制研究的过度。值得一提的是,其中环状RNA与microRNA相互作用是目前最常见的,也是项目数占比最多的研究思路,另外外泌体来源的环状RNA项目也比较多,也是目前环状RNA的重要方向。
那么接下来,小编将从以下几个角度讲解环状RNA目前的研究思路。
环状RNA是什么?
环状RNA(circRNAs)是一类不具有5’末端帽子和3’末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。目前发现的circRNAs主要来源于基因外显子exon,但还有其他类型,比如来源于内含子intron,基因间intergenic,反义链antisense,重叠区sense overlapping。

circRNA的主要特征有哪些呢?
(1) circRNA由于反式剪切,大量存在于真核细胞的细胞质中(定位于细胞质是miRNA海绵机制研究的充分必要条件),少部分内含子来源的circRNA存在于核酸内,具有一定的组织特异性、时序和疾病特异性(灰常适合做分子标志物哦)。circRNA广泛存在于人体细胞中,有时超过其线性异构体10倍之多。
(2) 与传统线性RNA相比,circRNA分子没有5’末端帽子和3’末端poly(A)尾巴,呈封闭环状结构,不易被核酸外切酶RNaseR降解,比线性RNA更稳定。(RNaseR耐受实验,验证circRNA的环形结构)
(3) 部分circRNA含有miRNA应答元件,可充当竞争性内源RNA(ceRNA),与miRNA结合,在细胞中起到miRNA海绵作用,进而解除miRNA对靶基因的抑制作用,上调靶基因的表达水平。(具体研究见下)
(4) 可以翻译成蛋白质,但大部分是非编码RNA。(与表观结合:可通过m6A甲基化翻译蛋白质[3])

2.环状RNA的研究思路是怎样的呢?
所谓兵马未动,粮草先行!环状RNA的研究也是一场没有硝烟的战争,须得抢占先机,方能知己知彼,百战不殆。为了各位在这场“战争”中取得胜利,云序生物为大家准备了环状RNA研究的思路宝典,如下。
从文章的工作量、难易程度及杂志发表角度看,小编把环状RNA研究思路分为表达谱分析,生物标志物,功能机制研究三大类。那么接下来小编将从这三个角度给大家详述。
不论从哪一个角度,首先需要确定好研究物种,疾病模型,样品类型等基本信息。接下来,通过高通量手段即RNA-seq(云序提供全转录组-seq或circRNA-seq)或文献报道,筛选差异表达的circRNA。如果想短平快的发表3-5分的文章,那么表达谱分析显得再合适不过了。如果有大量的临床样本,那么做分子标志物也是很easy的,思路和表达谱分析相似如下图展示,不过多了临床样本的统计和验证。(比如KM曲线,ROC曲线,PAM分析等等)

接下来,便是重头戏,circRNA功能机制研究如何进行呢?
这要看各位想从哪个角度入手了。目前circRNA研究的功能机制大致分为:miRNA海绵,与功能蛋白结合,顺势调控来源基因表达,还有就是circRNA上发生RNA甲基化可翻译蛋白质等。其中miRNA海绵是目前做的最普遍,也是目前申请的国自然里占比最多的。接下来小编会好好介绍一下这一方面的研究思路及研究方法。
miRNA海绵机制:
通过高通量测序手段得到一批数据后,很多人会犯愁到底怎么运用数据呢?想必下面这篇文章[4]大家都烂熟于心了吧?那么小编再次带大家领略一下高分环状RNA的风采。

高通量测序产生的数据,需要进一步实验手段进行验证。而在诸如Nature communication这类高分杂志中,验证工作可谓是面面俱到。不仅包括表达量验证,还包括结构验证,细胞定位及功能验证等。有的甚至还包括环状RNA形成机制的研究,在这儿不赘述。

体外差异环状RNA的验证
a表达量验证:qPCR
b结构验证:由于circRNA不易被核酸外切酶RNaseR降解,比线性RNA更稳定。可通过RNase R耐受性实验验证其环形结构。
c细胞定位:由于circRNA是在细胞质中发挥miRNA海绵机制,因此需要通过核质分离实验或FISH验证其在细胞中的定位。
d功能验证:对上述步骤筛选出的1-2条circRNA设计siRNA或者过表达质粒,通过一系列细胞表型实验,验证circRNA所发挥的细胞功能。最终挑选表型最为显著的circRNA做后续机制研究。


图示:差异circRNA验证 左:RNaseR耐受实验 右:FISH定位
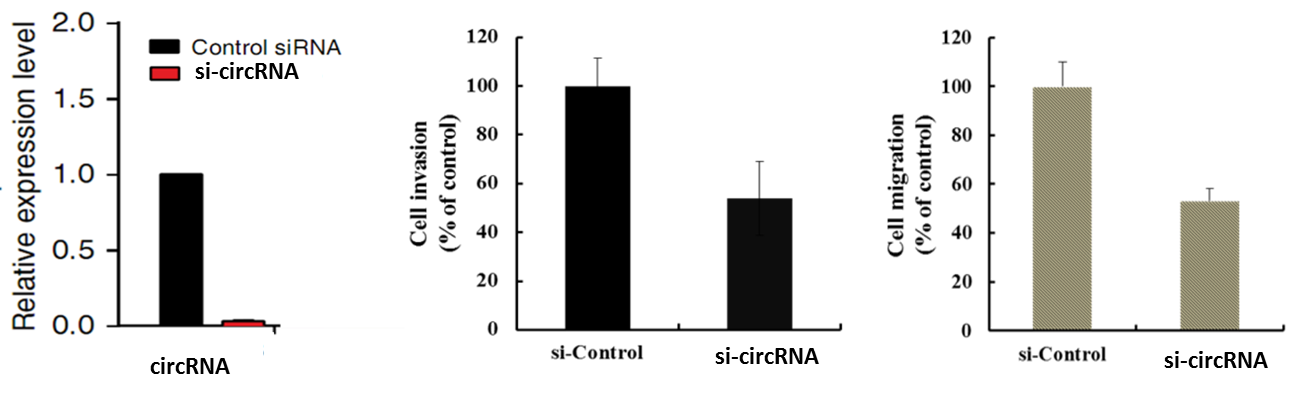
图示:差异环circRNA左:敲除实验 中:细胞侵袭 右:细胞迁移实验
目标circRNA的机制研究
a RIP-qPCR:挑选功能最为明显的1个circRNA做RIP-qPCR实验,检测circRNA是否与AGO2蛋白结合。(AGO2是circRNA发挥海绵作用的指示蛋白)
b RNA pull down:对上述circRNA进行RNA pull down实验,拉下来的RNA进行定量PCR检测,检测生信预测中与该circRNA结合的10-20疾病miRNA。
c luciferase assay:根据上步结果为circRNA挑选3个左右的miRNA做后续荧光素酶实验(miRNA与circRNA表达趋势一致),分别构建circRNA的荧光素酶载体,miRNA结合位点突变的荧光素酶载体。
将circRNA荧光素酶载体与3个miRNA mimics共转染至细胞,检测荧光活性,证明环状RNA和miRNA mimics的结合。
d miRNA功能实验:选定1个miRNA研究其对某一确定细胞表型和靶基因表达水平的影响(如:迁移);
e 恢复性实验:分别研究:单独转染nc mimics或单独转染miRNA mimics或单独转染环状RNA过表达质粒,及共转染环状RNA+miRNA mimics对某一确定细胞表型和环状RNA表达水平的影响。
f 回补性实验:敲除circRNA后,过表达靶基因,检测靶基因是否能逆转circRNA敲除导致的表型变化。

图示:差异环状RNA左:Ago2 RIP 中:荧光素酶筛选系统 右:miRNA pull down
既然是真情回馈,那么小编在这儿就给大家透露一个更容易get的研究海绵机制的思路如下图。可以同时做一下circRNA-seq和AGO2 RIP-seq,这样重叠部分的结果便是可能发挥海绵作用的circRNA。进而通过RNA pull down-WB反向验证circRNA与AGO2的相互作用,其他功能实验与上述一致。
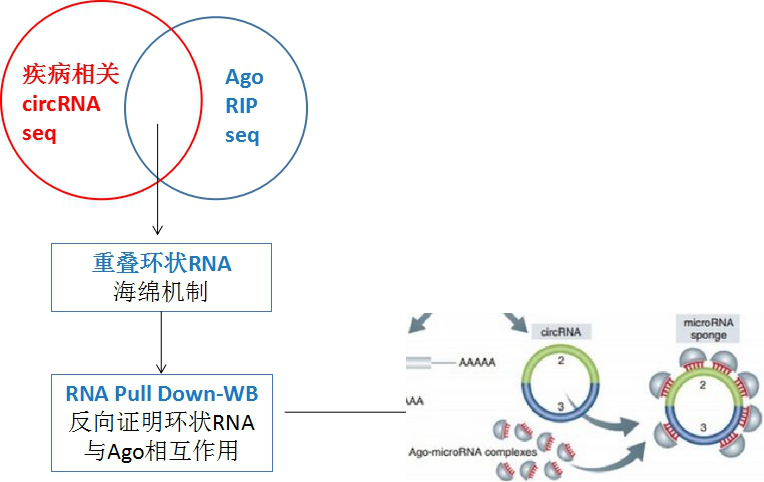
可如果我的circRNA不是海绵机制,咋办?别怕,小编给你出大招!
circRNA结合功能蛋白:
当你发现自己的circRNA不是发挥海绵作用的时候,是不是有种泪奔的感觉?

别怕,小编这就给你吃一颗定心丸。原来circRNA不仅可以与miRNA结合发挥海绵作用,还可以结合功能蛋白发挥作用呢!下面这篇就是很好的例子!和大家一样,这篇文章的作者也是先通过AGO2 RIP实验验证了他的circANRIL是否结合AGO2,但不幸的是,结果证实他彻底的和miRNA海绵say goodbye了,顿时小编也是捏了一把冷汗。可作者竟然奇迹般地扭转了局势,通过RNA pull down探索了circANRIL上结合的蛋白,并通过RIP反向证实了circRNA是通过与PES1蛋白结合参与了rRNA的成熟过程。想来功夫不负有心人,这篇文章也是成功地发表在Nature communication上[5]。


circRNA顺势调控来源基因表达:
这里小编给大家准备了一个被掩藏许久了的环状机制:circRNA顺势调控来源基因表达的研究思路,即通过特异的RNA-RNA互作来调控转录。
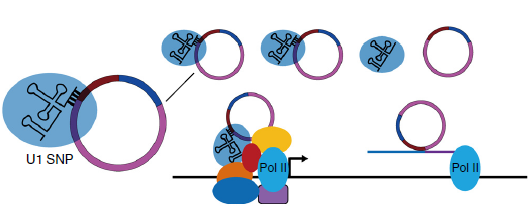
这篇文献,作者首先通过CLIP-seq(检测RNA结合蛋白下游的RNA)发现RNA聚合酶II上结合了一些circRNA。并且通过鉴定,发现是外显子与保留在外显子之间的内含子形成的环状RNA,命名为外显子-内含子circRNAs(EIciRNAs),其中显著富集的circEIF3J和circPAIP作为后续研究对象。研究这通过FISH定位发现其定位于细胞核,这提示作者可能不能走miRNA海绵的路子了。So what?
作者通过反义核苷酸技术沉默circEIF3J和circPAIP后检测来源基因表达,证实了其可调控来源基因表达。RNA-DNA共定位FISH也证实EIciRNAs与其来源基因共定位于细胞核中。此外这两个EIciRNAs与Pol II互作关系也都使作者提出一个大胆的猜想:EIciRNAs可能对其来源基因有调控作用。
带着这样的猜想,接下来作者先后通过RNA pull down(检测RNA与RNA/蛋白作用)和CHIRP(是一种检测与RNA绑定的DNA和蛋白相互作用的方法。)实验分析了与两个EIciRNAs相互作用的蛋白及RNA。结果发现EIciRNAs不仅可以与Pol II结合,还与U1A和U1C snRNP结合(它参与真核生物细胞核中RNA的加工。snRNA和许多蛋白质结合在一起成为小核核糖核蛋白(snRNP即small nuclear ribonucleoproteins),参与信使RNApre-mRN的剪接,使后者成为成熟mRNA。),且在细胞核内互作(FISH)。CHIRP实验证实EIciRNAs同Pol II、U1 snRNP共同结合于其来源基因转录起始位点上游300bp处,并且U1 snRNP的结合是必需的[8]。
circRNA翻译蛋白质:
假如这一切都不足以吸引你的眼球,那么接下来的这个案例可能会让你“跌破眼镜”。最初我们认为circRNA属于非编码RNA,不能发挥编码蛋白质的功能,那么事实真的如此么?Cell Research[3]这篇文章便告诉你:大错特错!环状RNA没有游离的5’和3’端,因此如果可以翻译的话一定是通过不依赖于5’帽子结构的方式。根据目前报道的环状RNA翻译蛋白的调控元件包括IRES和m6A修饰两种途径。
已知一些mRNA可以不依赖于帽子结构而靠一个叫内部核糖体进入位点(IRSE)的顺式调控元件来从mRNA的中间启动翻译,作者基于这种思想,检测发现自己的环状RNA上并没有IRES,却同样可以翻译蛋白。然而一直有报道称m6A可调控翻译,但并没有系统的研究,作者大胆猜想是否环状RNA上也发生了m6A修饰,并调控蛋白翻译呢?
结果不出所料,环状RNA的翻译可被RNA甲基化酶调控。作者通过一系列实验证实YTHDF3可识别circRNA上发生的m6A修饰,并招募翻译起始因子eIF3A和eIF4G2等,起始蛋白翻译。


不仅如此,环状RNA编码的蛋白质还是有功能的呢,如下面两篇文章[6][7]。


说道翻译蛋白质的研究思路,稍微复杂一些,那么小编给大家总结一下。
1. 翻译启动元件预测分析:
IRES是internal ribosome entry site的简写,是一种具备募集核糖体并实现核糖体组装和后续阅读框翻译蛋白的RNA调控元件。
2. 阅读框预测:
阅读框是Open Reading Frame的简写,指在核酸序列中从ATG开始(RNA中是AUG),三个碱基一组,直至出现TAA,TAG或TGA(RNA中A变成U)终止密码子的序列。
3. 载体表达验证实验:
通过构建正常元件和元件突变载体,即把预测到的IRES或m6A修饰位点突变掉,看后续的翻译是否正常进行。
4. 阅读框表达验证实验:
通过在原有的阅读框前端增加标签序列,包括3×Flag等标签,验证阅读框产物在生理条件下是否可以实现。
5. 内源性翻译产物鉴定:
通过制备特异性抗体进行Western等检测实验。这部分需要进行抗体特异性证明实验,包括模拟翻译产物的过表达和敲除实验等,特异性可以通过WB和IP下来质谱鉴定。
6. 核糖体结合分析:
基于蔗糖密度梯度离心的核糖体分离技术,鉴定环状RNA上是否结合核糖体,以及结合的多少。
7. 翻译产物过表达和敲低(除)实验:
通过构建过表达或敲低/敲除体系,看不同含量的翻译产物对细胞生理指标的影响情况。
3.环状RNA项目国自然申请建议
(1) 避免单纯设计表达谱的研究内容。尽早进行表达谱分析,找到有研究价值的目标环状RNA,并开展一些简单的验证实验,最好能形成大致的功能机制研究的轮廓。
(2) 开展新颖的环状RNA研究方向。包括对尚未报道或极少报道的病理或生理模型相关的环状RNA筛选鉴定,或者机制研究方向上,比如miRNA海绵,与功能蛋白相互作用,与表观水平结合,翻译蛋白质方向等。
(3) 利用多种有效地分析环状RNA与其他分子或蛋白相互作用的研究工具。包括RIP,RNA pull-down,CLIP等实验技术,如果能得到有效数据,会在国自然科学基金申请中增色不少。
参考文献
1. Memczak S, Jens M, Elefsinioti A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency.[J]. Nature, 2013, 495(7441):333.
2. Hansen TB, Jensen TI, Clausen BH, et al. Natural RNA circles function as efficient microRNA sponges[J]. Nature, 2013, 495(7441):384-388.
3. Yun Y, Fan X, Mao M, et al. Extensive translation of circular RNAs driven by N6-methyladenosine[J]. Cell Research, 2017, 27(5):626.
4. Zheng Q, Bao C, Guo W, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs[J]. Nature Communications, 2016, 7(11215):11215.
5. Holdt L M, Anika S, Kristina S, et al. Circular non-coding RNAANRILmodulates ribosomal RNA maturation and atherosclerosis in humans:[J]. Nature Communications, 2016, 7:12429.
6. Legnini I, Timoteo G D, Rossi F, et al. Circ-ZNF609 Is a Circular RNA that Can Be Translated and Functions in Myogenesis[J]. Molecular Cell, 2017, 66(1):22.
7. Yang Y, Gao X, Zhang M, et al. Novel Role of FBXW7 Circular RNA in Repressing Glioma Tumorigenesis.[J]. Journal of the National Cancer Institute, 2018, 110(3).
8. Li Z, Huang C, Bao C, et al. Exon-intron circular RNAs regulate transcription in the nucleus.[J]. Nature Structural & Molecular Biology, 2015, 22(3):256.
参考文献:Circular RNA expression alteration in exosomes from the brain extracellular space after traumatic brain injury in mice
云序生物推荐
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江区莘砖公路518号20号楼3楼
电话:021-64878766
传真:021-64878766
网址:www.cloud-seq.com.cn
邮箱:market@cloud-seq.com.cn




